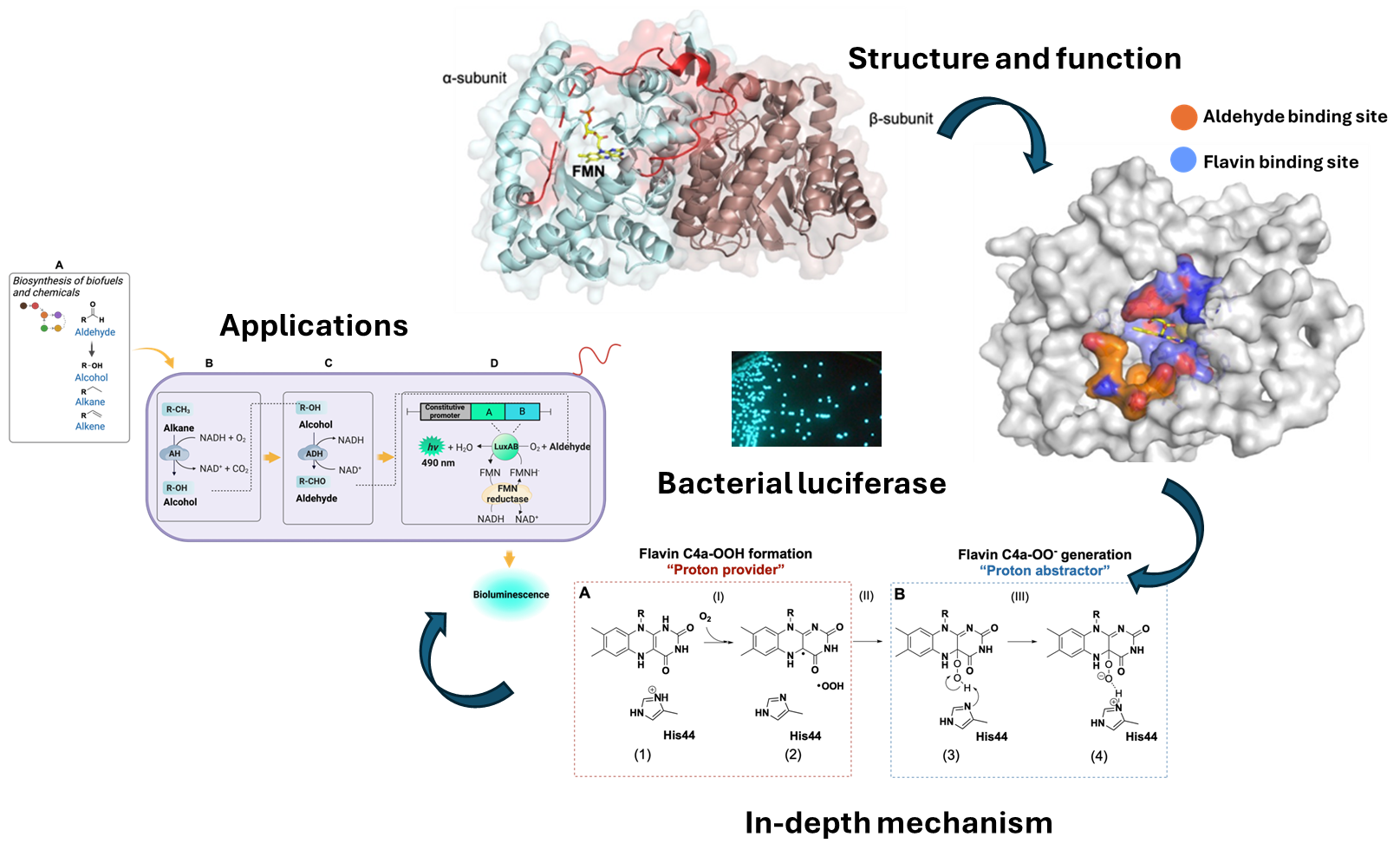
Bacterial luciferase (LuxAB) catalyzes the conversion of reduced flavin mononucleotide (FMNH2), oxygen, and a long-chain aldehyde to oxidized FMN, the corresponding acid and water with concomitant light emission. This bioluminescence reaction requires the reaction of a flavin reductase such as LuxG (in vivo partner of LuxAB) to supply FMNH2 for the LuxAB reaction. LuxAB is a well-known self-sufficient luciferase system because both aldehyde and FMNH2 substrates can be produced by the associated enzymes encoded by the genes in the lux operon, allowing the system to be auto-luminous. This makes it useful for in vivo applications. Structural and functional studies have long been performed in efforts to gain a better understanding of the LuxAB reaction. Recently, continued exploration of the LuxAB reaction elucidated the mechanisms of C4a-hydroperoxyflavin formation and identified key catalytic residues such as His44 that facilitates the generation of flavin intermediates important for light generation. Advancements in protein engineering and synthetic biology have improved the bioluminescence properties of LuxAB. Various applications of LuxAB for bioimaging, bioreporters, biosensing in metabolic engineering and real-time monitoring of aldehyde metabolites in biofuel production pathways have been developed during the last decade. Challenging issues such as achieving red-shifted emissions, optimizing the signal intensity and identifying mechanisms related to the generation of light-emitting species remain to be explored. Nevertheless, LuxAB continues to be a promising tool for diverse biotechnological and biomedical applications.
เอนไซม์ลูซิเฟอเรสจากแบคทีเรีย หรือ LuxAB เป็นเอนไซม์ที่สามารถเร่งปฏิกิริยาเรืองแสง โดยเปลี่ยนสารรีดิวซ์ฟลาวินโมโนนิวคลีโอไทด์ (FMNH2) โดยใช้ออกซิเจนและอัลดีไฮด์สายยาวไปเป็นออกซิไดซ์ FMN ทั้งนี้ปฏิกิริยาการเรืองแสงนี้ต้องการตัวช่วยคือเอนไซม์ฟลาวินรีดักเตส เช่น LuxG เพื่อสร้าง FMNH2 สำหรับส่งต่อให้กับปฏิกิริยา LuxAB เอนไซม์ LuxAB ถือเป็นหนึ่งในระบบลูซิเฟอเรสที่สับสเตรททุกตัวสามารถสร้างโดยเอนไซม์ที่อยู่ใน lux operon เดียวกัน ดังนั้นเมื่อเอนไซม์ใน lux operon แสดงออกร่วมกับ LuxAB ก็จะสามารถทำใหเซลล์ทั้วไป กลายเป็นเซลล์ที่ส่องสว่างอัตโนมัติได้ (autoluminescent cell) สิ่งนี้เองทำให้ LuxAB มีประโยชน์อย่างมากสำหรับการทดลองในแบบ vivo อย่างไรก็ตาม แม้จะมีการศึกษาปฏิกิริยาเชิงลึก โครงสร้างและหน้าที่ของ LuxAB มาเป็นเวลานานแล้ว แต่ยังมีข้อมูลหลายอย่างเกี่ยวกับปฏิกิริยาการสร้างแสงของ LuxAB ที่ยังไม่เป็นที่ทราบแน่ชัด จึงมีงานวิจัยจากนักวิจัยหลายกลุ่มพยายามศึกษาเพื่อทำความเข้าใจปฏิกิริยา LuxAB ให้ดียิ่งขึ้น ดังมีรายงานเพิ่มเติมเกี่ยวกับการอธิบายกลไกของการก่อตัวของ C4a-hydroperoxyflavin และระบุตัวเร่งปฏิกิริยาที่สำคัญ เช่น กรดอะมิโน His44 ในบริเวณเร่งที่สำคัญต่อการสร้างสารตัวกลางฟลาวินที่แอคทีฟ นอกจากนี้ความก้าวหน้าในด้านวิศวกรรมโปรตีนและชีววิทยาสังเคราะห์ได้ช่วยปรับปรุงคุณสมบัติการเรืองแสงในระบบของ LuxAB สำหรับการใช้งานต่างๆ เช่น สำหรับการถ่ายภาพทางชีวภาพ, ตัวชี้วัดทางชีวภาพ, การตรวจจับทางชีวภาพในวิศวกรรมเมตาบอลิซึม และการตรวจสอบแบบเรียลไทม์ของสารเมตาบอไลต์ชนิดอัลดีไฮด์ในวิถีการผลิตเชื้อเพลิงชีวภาพ และ LuxAB ยังคงเป็นเครื่องมือที่มีการใช้งานด้านเทคโนโลยีชีวภาพและชีวการแพทย์ต่างๆ อย่างต่อเนื่อง
Reference
Kantiwiriyawanitch, C., Leartsakulpanich, U., Chaiyen, P., Tinikul, R. Mechanisms and applications of bacterial luciferase and its auxiliary enzymes. Archives of Biochemistry and Biophysics, 2025, 765, 110307.
Relevant SDGs

BC investigator

