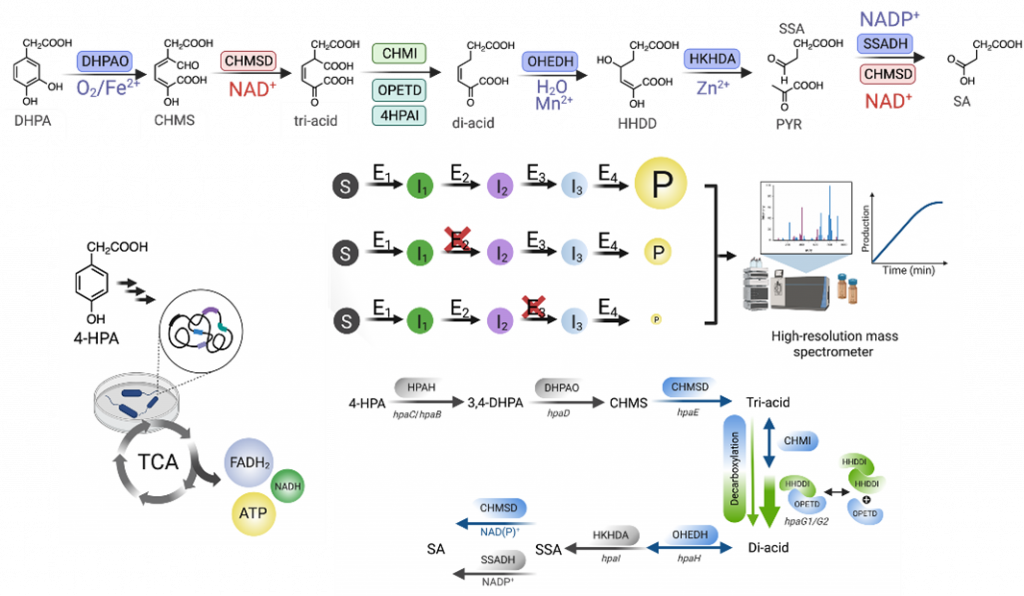
The 4-hydroxyphenylacetate (4-HPA) degradation pathway enables environmental and pathogenic microbes to assimilate aromatic compounds, yet several steps in Acinetobacter baumannii TH remain unclear. While enzymes catalyzing the initial and terminal reactions have been characterized, those functioning in the middle of the pathway were previously unassigned. Here, we identify and biochemically characterize the enzymes responsible for these missing steps, including CHMS dehydrogenase (CHMSD), CHM isomerase (CHMI), OPET decarboxylase (OPETD), HHDD isomerase (HHDDI), and OHED hydratase (OHEDH). Using enzymatically synthesized OPET, we show that efficient decarboxylation requires the combined action of OPETD, CHMI, and HHDDI, with CHMI mediating triacid tautomerization and protein–protein interactions between OPETD and HHDDI enhancing OHED formation. OHEDH is distinguished by its strict dependence on Mn²⁺ as a cofactor. Notably, CHMSD can also utilize succinic semialdehyde, suggesting functional redundancy with SSADH. This study completes the functional assignment of all enzymes in the 4-HPA degradation pathway and provides a foundation for inhibitor development or biocatalytic cascade design.
การค้นพบและการศึกษาลักษณะทางชีวเคมีของเอนไซม์ในวิถีการย่อยสลาย 4-ไฮดรอกซีฟีนิลอะซีเตตใน Acinetobacter baumannii TH
วิถีการย่อยสลาย 4-ไฮดรอกซีฟีนิลอะซีเตต (4-HPA) ช่วยให้จุลชีพทั้งในสิ่งแวดล้อมและเชื้อก่อโรคสามารถนำสารประกอบอะโรเมติกมาใช้ประโยชน์ได้ อย่างไรก็ตาม ปฏิกิริยาในหลายขั้นตอนของวิถีงดังกล่าวใน Acinetobacter baumannii TH ยังคงไม่ชัดเจน แม้ว่าเอนไซม์ที่เร่งปฏิกิริยาในส่วนแรกและส่วนสุดท้ายจะได้รับการศึกษาอย่างชัดเจนแล้ว แต่เอนไซม์ที่ทำหน้าที่ในช่วงกลางของวิถียังไม่เคยถูกกำหนดหน้าที่มาก่อน ในงานวิจัยนี้เราได้พัฒนาวิธีการสังเคราะห์สารตัวกลางด้วยวิธี one-pot biosynthesis เพื่อนำมาใช้ศึกษาปฏิกิริยาเอนไซม์ในวิถีนี้ ได้แก่ เอนไซม์ CHMS dehydrogenase (CHMSD), CHM isomerase (CHMI), OPET decarboxylase (OPETD), HHDD isomerase (HHDDI) และ OHED hydratase (OHEDH) จากผลการศึกษาพบว่า ประสิทธิภาพการดีคาร์บอกซิเลชันสูงสุดเกิดขึ้น เมื่อมี 3 เอนไซม์ทำงานร่วมกัน คือ OPETD, CHMI และ HHDDI นอกจากนี้เราแสดงให้เห็นว่า CHMI มีบทบาทในการเปลี่ยนทอโทเมอร์ของสารไตรแอซิด ขณะที่ปฏิสัมพันธ์ระหว่างโปรตีนของ OPETD และ HHDDI ช่วยเพิ่มประสิทธิภาพการดีคาร์บอกซิเลชันโดย OPETD เพื่อสร้าง OHED ซึ่งเป็นสารไดแอซิด นอกจากนี้เรายังค้นพบสิ่งใหม่ที่พบว่า CHMSD สามารถทำหน้าที่ทดแทน SSADH ในการสร้างซักซิเนตเพื่อการใช้ประโยชน์ของเซลล์ได้ องค์ความรู้จากงานวิจัยนี้เป็นประโยชน์ต่อการพัฒนาสารยับยั้งที่มุ่งเป้าไปยังเอนไซม์เฉพาะของจุลชีพก่อโรค และการเปลี่ยนสารประกอบที่ได้จากลิกนินให้เป็นสารชีวเคมีที่มีมูลค่าสูงได้
Reference
Chinantuya W, Kungchuai K, Chaiyen P, Maenpuen S, Tinikul R. Discovery and biochemical characterization of enzymes completing the 4-hydroxyphenylacetate pathway in Acinetobacter baumannii TH. J Biol Chem. 2025, 301, 110917.
Relevant SDGs

BC investigator

