English
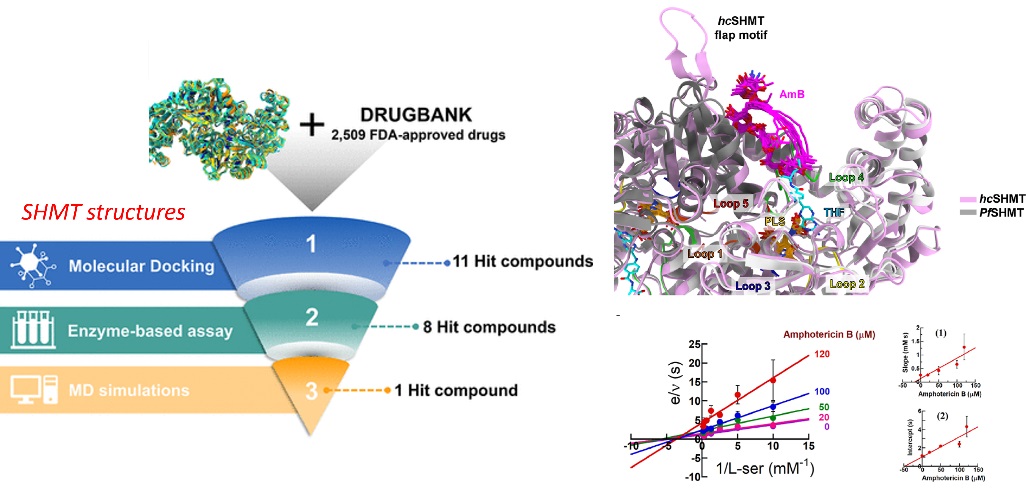
Serine hydroxymethyltransferase (SHMT) is a key enzyme in deoxythymidylate synthesis pathway. It has been identified as a promising target for drug combating many pathogens as well as malaria. Malaria has become the most concerning disease as showing increased drug-resistant rates of the Plasmodium parasite. By using a molecular docking against Plasmodium SHMT structures, this study found eight compounds out of 2509 US Food and Drug Administration (FDA)-approved drugs showing a significantly lower binding energy. In vitro inhibition assay was then investigated using Plasmodium falciparum SHMT (PfSHMT) and results showed that amphotericin B was a competitive inhibitor of PfSHMT with a half-maximal inhibitory concentration (IC50) of 106±1 μM. A 500 ns molecular dynamics simulation of Pf SHMT/PLS/amphotericin B was then performed to get insight into molecular interaction. The appreciable binding affinity of amphotericin B for PfSHMT was indicated by their solvated interaction energy (-11.15±0.09 kcal/mol) and supported by strong ligand-protein interactions (≥80% occurrences) with its essential residues (i.e., Y78, K151, N262, F266, and V365) interacting. Therefore, our findings identify a promising new PfSHMT inhibitor, and suggest a core structure that differs from that of previous SHMT inhibitors, thus being a rational approach for novel antimalarial drug design.
Thai
Serine hydroxymethyltransferase (SHMT) เป็นเอนไซม์สำคัญในวิถีการสังเคราะห์สารพันธุกรรมหรือ DNA ที่ได้รับการยอมรับว่าเป็นเป้าหมายสำคัญสำหรับยาเพื่อยับยั้งเชื้อโรคหลายชนิด รวมถึงโรคมาลาเรีย ซึ่งมาลาเรียกลายเป็นโรคที่น่ากังวลมากที่สุดเนื่องจากปรสิตพลาสโมเดียมซึ่งก่อโรคมีอัตราการดื้อยาเพิ่มขึ้น ในการศึกษานี้ต้องการค้นหาตัวยาชนิดใหม่ๆ เพื่อต่อสู้กับโรคมาลาเรีย โดยได้ศึกษาการจับกันของยาจำนวน 2,509 ชนิด ที่ได้รับการรับรองจากสำนักงานคณะกรรมการอาหารและยาแห่งสหรัฐอเมริกา (FDA) กับโครงสร้างเอนไซม์พลาสโมเดียม SHMT และพบสารประกอบ 8 ชนิด ที่สามารถเข้าจับได้ดีกับโครงสร้างเอนไซม์พลาสโมเดียม SHMT ผลจาการตรวจสอบความสามารถในการยับยั้งเอนไซม์พลาสโมเดียม ฟัลซิพารัม SHMT (PfSHMT) ในหลอดทดลอง แสดงให้เห็นว่าแอมโฟเทอริซิน B (amphotericin B ) เป็นตัวยับยั้งแบบแข่งขันของเอนไซม์ PfSHMT ที่มีค่า IC50 ที่ 106±1 ไมโครโมลาร์ จากการจำลองพลวัตของการจับกันของโมเลกุล PfSHMT และ amphotericin B ทำให้ความเข้าใจปฏิสัมพันธ์ของโมเลกุลและสามารถระบุอันตรกิริยาระดับโมเลกุลของ amphotericin B และโครงสร้าง PfSHMT ที่สามารถเป็นแนวทาสำหรับการออกแบบยาต้านมาลาเรียแบบใหม่ในอนาคต
Reference
Mee-Udorn P, Phiwkaow K, Tinikul R, Sanachai K, Maenpuen S, Rungrotmongkol T. In Silico and In Vitro Potential of FDA-Approved Drugs for Antimalarial Drug Repurposing against Plasmodium Serine Hydroxymethyltransferases. ACS Omega. 2023, 8(39):35580-35591.
DOI: 10.1021/acsomega.3c01309.
| Relevant SDGs | |
|---|---|
| BC investigator | |
 Asst. Prof. Ruchanok Tinikul Asst. Prof. Ruchanok Tinikul |
|
